METADONA


Farmacocinética da Metadona
Absorção:
A metadona é um dos opióides mais lipofílicos. Possui uma boa absorção ao nível do trato gastrointestinal, pelo que a sua biodisponibilidade oral é superior a 80 % (Infarmed, 2015) e, deste modo, varia entre 0,67 e 0,95. Após administração oral na forma de solução, o tempo que decorre até a metadona atingir o pico plasmático máximo é de 2,5h. Quando esta administração é feita na forma de comprimidos, o tempo é de 3h (Garrido & Trocóniz, 1999).
As concentrações no estado de equilíbrio (Css) são atingidas dentro de 5-7 dias (Infarmed, 2015).
Distribuição:
Frequentemente verifica-se que o volume aparente de distribuição no estado estacionário (Vss) é muito superior ao volume fisiológico real, o que demonstra que a ligação aos tecidos (provavelmente a lipoproteínas) é predominante em comparação com a ligação às proteínas plasmáticas (albumina, entre outras). Ainda assim, a ligação às proteínas plasmáticas ocorre em grande escala. Como possui propriedades básicas, a metadona liga-se ao AGG (α1-glicoproteína ácida), uma proteína da fase aguda que apresenta grandes variações de concentração no plasma, dado que depende da fisiologia do indivíduo (peso, sexo, entre outros) e ainda varia com a presença de certas patologias. A título de exemplo, em condições de stress esta glicoproteína encontra-se muito aumentada (Garrido & Trocóniz, 1999; Infarmed, 2015).
Metabolismo:
Excreção:
A metadona e os seus metabolitos são excretados pela urina e pela bílis. O aumento da acidez urinária aumenta em grande escala essa excreção, visto que a metadona é uma base fraca. Quando o pH da urina é superior a 6, a depuração renal constitui apenas 4% da eliminação total da droga. Quando o pH é inferior a 6, a metadona excretada por via renal pode representar 30% da dose total administrada (Garrido & Trocóniz, 1999). Posto isto, verifica-se que os acidificantes da urina como cloreto de amónio e ácido ascórbico podem aumentar a depuração renal da metadona. Relativamente à excreção hepática, esta representa cerca de 30% da dose administrada. Contudo, a percentagem referida tende a diminuir em doses mais elevadas (Infarmed, 2015).
Existem outras vias de excreção deste fármaco menos relevantes, como o suor, saliva, leite materno e cordão umbilical (Infarmed, 2015). Já foram estudados os níveis de metadona no leite de mulheres que estavam a efetuar terapia de substituição de heroína e a conclusão obtida foi que a amamentação é segura, desde que essa terapia seja com baixas concentrações (Wojnar-Horton et al., 1997).
O tempo de semi-vida da metadona é muito variável, desde 15 até 60h. É, no entanto, considerada como um opiáceo de t1/2 longo (Couper, Chopra, & Pierre-Louis, 2005). A clearance é outro parâmetro farmacocinético que varia consideravelmente. Pacientes com dor crónica apresentam, em média, uma clearance de 1,5 ml/min/kg, enquanto viciados em opióides apresentam 3,1 ml/min/kg (Garrido & Trocóniz, 1999).
-
Garrido, M. a. J., & Trocóniz, I. F. (1999). Methadone: a review of its pharmacokinetic/pharmacodynamic properties. Journal of Pharmacological and Toxicological Methods, 42(2), 61-66. doi: http://dx.doi.org/10.1016/S1056-8719(00)00043-5
-
Infarmed, Resumo das Caracteristicas do Medicamento: Misyo. Aprovado a 16-02-2015. Disponível em: http://www.infarmed.pt/infomed/download_ficheiro.php?med_id=55701&tipo_doc=rcm (acedido em 19-05-2015)
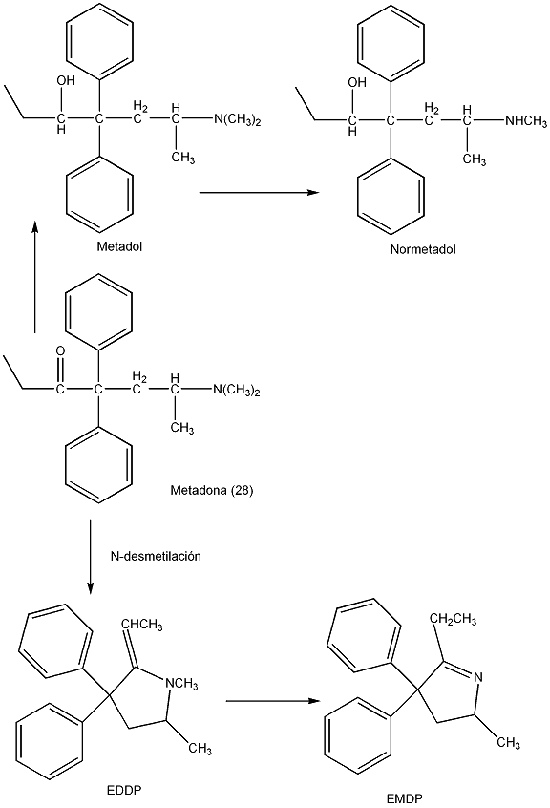
A metadona é metabolizada ao nível hepático, pelo Citocromo P450. O biotransformação é efetuada, principalmente, por N-desmetilação. Esta reação é catalisada pelo CYP3A4 e, em menor escala, CYP2C19 e o CYP2C9 (Garrido & Trocóniz, 1999) também poderão estar envolvidos. Embora a metadona seja capaz de alterar vários substratos da CYP2D6, pensa-se que esta enzima não tenha responsabilidade na metabolização deste opiáceo.
Da metabolização hepática formam-se metabolitos inativos, tais como: 2-etilideno,1,5-dimetil-3,3-difenilpirrolidina (EDDP) e 2-etil-5-metil-3,3-difenil-1-pirrolidina (EMDP). Outros metabolitos que se formam com alguma relevância são o metadol, a partir da hidroxilação da metadona e normetadol, que não é mais do que o metadol que sofreu N-desmetilação. No total, conhecem-se oito metabolitos da metadona (Infarmed, 2015).
As variações interindividuais na expressão de CYP3A4 influenciam intensivamente a variabilidade na clereance da metadona. Para além disto, pensa-se que a metadona tenha capacidade de induzir o seu próprio metabolismo, na medida em que induz o aumento da expressão de CYP3A4 (Garrido & Trocóniz, 1999).
Existem evidências que a farmacocinética dos enantiómeros varia significativamente no que diz respeito à distribuição e eliminação.
Em pacientes com dor crónica, a R-metadona e a S-metadona apresentaram volumes de distribuição de, respetivamente, 496,61L e 289,1L. As diferenças encontradas poderão dever-se à seletividade na ligação a proteínas plasmáticas.
Em relação à absorção, não foram encontradas diferenças entre os enantiómeros (Garrido & Trocóniz, 1999).
